جهازي المناعي وكيفية قتل الاجسام الغريبة
بعض الدلائل على الخلايا التائية البشرية والخلايا البائية والتضخم
طرق القتل: -
1- داخل الخلايا المعتمد على الأكسجين: عندما تبتلع البلعمة. البكتيريا (أو أي مادة) ، يزداد استهلاكها للأكسجين. تؤدي الزيادة في استهلاك الأكسجين ، والتي تسمى انفجار الجهاز التنفسي ، إلى إنتاج جزيئات تفاعلية تحتوي على الأكسجين ومضادة للميكروبات. تعتبر مركبات الأكسجين سامة لكل من الغازي والخلية نفسها ، لذلك يتم الاحتفاظ بها في مقصورات داخل الخلية. يشار إلى هذه الطريقة لقتل الميكروبات الغازية باستخدام الجزيئات المحتوية على الأكسجين التفاعلي باسم القتل داخل الخلايا المعتمد على الأكسجين. منها نوعان. النوع الأول هو إنتاج الأكسيد الفائق المعتمد على الأكسجين ، وهو مادة قاتلة للبكتيريا غنية بالأكسجين. يتم تحويل الأكسيد الفائق إلى بيروكسيد الهيدروجين والأكسجين المفرد بواسطة إنزيم يسمى ديسموتاز الفائق ، كما يتفاعل بيروكسيد الهيدروجين لإنتاج جذور الهيدروكسيل ، والتي تساعد في قتل الميكروب الغازي. النوع الثاني يتضمن استخدام إنزيم myeloperoxidase (MPO) من حبيبات العدلات. عندما تندمج الحبيبات مع البلعمة ، يتم إطلاق الميلوبيروكسيديز في البلعمة ، ويستخدم هذا الإنزيم بيروكسيد الهيدروجين والكلور لإنتاج هيبوكلوريت ، وهي مادة تستخدم التبييض المنزلي. هيبوكلوريت شديد السمية لصبغة الهيم ، والتي تمثل اللون الأخضر للإفرازات الغنية بالعدلات. مثل القيح والبلغم المصاب بكتيريا. يحتوي Myeloperoxidase على خلايا بلعمية داخل الخلايا مستقلة عن الأكسجين 2 يمكنها أيضًا قتل الميكروبات بطرق مستقلة عن الأكسجين ، ولكنها ليست فعالة مثل تلك المعتمدة على الأكسجين. هناك أربعة أنواع رئيسية. الأول يستخدم بروتينات مشحونة كهربائيًا تتلف غشاء البكتيريا. النوع الثاني يستخدم الليزوزيمات. هذه الإنزيمات تكسر جدار الخلية البكتيرية. النوع الثالث يستخدم اللاكتوفيرينات الموجودة في حبيبات العدلات وتزيل الحديد الأساسي من البكتيريا. النوع الرابع يستخدم البروتياز والإنزيمات المتحللة للماء. تستخدم هذه الإنزيمات لهضم بروتينات البكتيريا المدمرة.
الدور في موت الخلايا المبرمج في الحيوان
تموت الخلايا باستمرار. التوازن بين انقسام الخلايا وموت الخلايا يحافظ على عدد الخلايا ثابتًا نسبيًا عند البالغين ، وهناك طريقتان مختلفتان يمكن للخلية أن تموت بها: عن طريق التصلب أو موت الخلايا المبرمج. على عكس النخر ، الذي ينتج غالبًا عن مرض أو صدمة ، فإن موت الخلايا المبرمج أو موت الخلايا المبرمج هو وظيفة صحية طبيعية للخلايا. يجب على الجسم تخليص نفسه من ملايين الخلايا الميتة أو المحتضرة كل يوم ، وتلعب البالعات دورًا حاسمًا في هذه العملية. تعرض الخلايا المحتضرة التي تمر بالمراحل الأخيرة من موت الخلايا المبرمج جزيئات ، مثل فوسفاتيديل سيرين ، على سطح خلاياها لجذب البالعات. تحدد هذه الجزيئات الخلية الخاصة بالبلعمة بواسطة الخلايا التي تمتلك المستقبلات المناسبة ، مثل البلاعم. تتم إزالة الخلايا المحتضرة بواسطة البالعات بطريقة منظمة دون إثارة استجابة التهابية وهي وظيفة مهمة للبالعات. تنقسم أنواع البلعميات من البشر إلى مجموعات "مهنية" و "غير مهنية" بناءً على الكفاءة التي يشاركون بها في البلعمة. 1-البلعمات المحترفة هي الخلايا الوحيدة ، العدلات الضامة. الخلايا المتغصنة الأنسجة والخلايا البدينة. يحتوي لتر واحد من دم الإنسان على حوالي ستة مليارات خلية بلعمية. 2 - البالعات غير المحترفة الخلايا المحتضرة والعضوية الغريبة تستهلكها خلايا غير البالعات "المهنية". وتشمل هذه الخلايا الخلايا الظهارية. الخلايا البطانية. الخلايا الليفية والخلايا الوسيطة. يطلق عليهم اسم البلعمة غير المحترفة ، على عكس البلعمات المحترفة ، فإن البلعمة ليست وظيفتها الرئيسية ، على سبيل المثال ، التي يمكن أن تقوم بالكولاجين البلعمي في عملية إعادة تشكيل الندبات ، ستبذل أيضًا بعض المحاولات لابتلاع جزيئات غريبة. البالعات غير المحترفة هي أكثر محدودية من البالعات المحترفة في نوع الجسيمات التي يمكن أن تلتقطها. ويرجع ذلك إلى افتقارها إلى مستقبلات البلعمة الفعالة ، وخاصة الأوبسونين ، وهي أجسام مضادة ومكملات مرتبطة بالغزاة من قبل الجهاز المناعي. بالإضافة إلى ذلك ، لا تنتج جزيئات تفاعلية تحتوي على الأكسجين استجابة للبلعمة. البالعات الجليدية تفعل
التكتيكات المستخدمة من قبل مسببات الأمراض لتجنب القتل بالبلعمات أ. قتل أو قتل (السمية الخلوية) العقدية العقدية Streptolysin O Bordetella الشاهوق Adenylate Cyclase B. تمنع التأين أو تعطيل البلعمة 1. كبسولة: S. pneumoniae 2. M البروتين: S. pyogenes 3. تعطيل الإشارات: بروتينات RhoGAP C. البقاء على قيد الحياة القتل داخل الخلايا 1. منع اندماج phagosome-lysosome: M. tb. 2. الهروب من البلعمة: ريكتسلا 3. الإنزيمات الليزوزومية على قيد الحياة: السالمونيلا.
الاجسام المضادة
الجسم المضاد (AB) ، المعروف أيضًا باسم الغلوبولين المناعي (Ig) ، هو بروتين كبير على شكل Y تنتجه خلايا البلازما ويستخدمه الجهاز المناعي للتفاعل مع Ag الذي يحفز إنتاجها. أهم وظيفة لهيكل Abs الأساسي لـ Abs. يحتوي الغلوبولين المناعي البشري على أربع سلاسل من عديد الببتيدات: سلسلتان خفيفتان متطابقتان وسلاسل ثقيلة متطابقة مرتبطة بروابط ثاني كبريتيد لتشكيل وحدة أحادية كل سلاسل ثقيلة وخفيفة تنقسم إلى مناطق متجانسة تسمى المجالات ، والسلاسل الخفيفة التي يطلق عليها كابا K أو لامدا أ مشفرة على الكروموسومات 2 و 22 على التوالي تم العثور على سلاسل K و 67٪ و 33٪ على التوالي. ، هناك خمسة أنواع من السلاسل الثقيلة ، جميعها مشفرة على الكروموسومات 14 ، ويطلق عليها mu (u) ، و delta (8) ، و gamma (y) ، و epsilon (8) ، و alpha (a). الاختلاف الجيني في السلاسل الخفيفة والثقيلة كوون.
Assist LAhrmed A حسن الأنماط النظيرية يتم تحديد الفئة الفرعية من الجلوبيولين المناعي من خلال النمط النظري للسلسلة الثقيلة. على سبيل المثال ، تختلف الفئات الفرعية IgG في عدد روابط ثاني كبريتيد وطول ومرونة منطقة المفصلة. 1-سلاسل الضوء: يحتوي مونومر الغلوبولين المناعي على سلسلتين متطابقتين من كابا أو سلسلتين متطابقتين من سلاسل لامدا الخفيفة ولكن لا يحتوي على واحدة من كل منهما. تحتوي السلسلة الخفيفة على مجال متغير (V1) ومجال ثابت (C) يحتوي كل مجال على حوالي 110 من الأحماض الأمينية ورابطة ثنائي كبريتيد داخل السلسلة. سميت المناطق المتغيرة (في كل من السلاسل الثقيلة والخفيفة) بهذا الاسم لتباينها في تسلسل الأحماض الأمينية بين الغلوبولين المناعي المركب بواسطة الخلايا البائية المختلفة. 2- السلاسل الثقيلة: تحتوي الثقيلة على متغير واحد (VH) وثلاثة أو أربعة نطاقات ثابتة (CH). نطاقات متغيرة السلسلة الثقيلة (H) متنوعة للغاية ، والمجالات الثابتة (CH) تعرض تباينًا محدودًا نسبيًا لأعضاء الأنماط المتشابهة. تحتوي السلاسل 8 و y والسلاسل الثقيلة على ثلاثة مجالات ثابتة (Cn ، C12 ، CH3) ، وتحتوي السلاسل u و الثقيلة على مجال ثابت رابع (CH4) ، مما يجعلها أطول وأثقل من ô ، y ، أو سلاسل ثقيلة 3-مواقع ربط مستضد: يشكّل مجال متغير خفيف السلسلة ومجال متغير ثقيل السلسلة معًا جيبًا يشكل مولد الضد (epitope) - يحتوي مونومر الغلوبولين المناعي (Paratope) على سلسلتين خفيفتين متطابقتين وسلاسل ثقيلة متطابقة ، موقعان الارتباط الموجودان في كل غلوبولين مناعي أحادي من جزيئات الغلوبولين المناعي لأن أحدهما متطابق أيضًا. 4- مجالات سلسلة Ig: L (2): سلسلة V و CL و H (4-5): VH و CHI و CH2 و CHB CHI (في IgM و IgE). 1-VH ، VL موقع ربط مولد الضد CHI ، 2- CL: علامة خيفي 3- C12 / CHB: موقع تثبيت مكمل. 4-CH / CH4: موقع ربط الخلية 5-S-S: سلسلة داخلية بين نفس السلسلة وسلسلة داخلية بين سلاسل مختلفة 6- منطقة المفصلة عبارة عن تسلسل ببتيد ممتد بين مجالات CHI و CH2 التي توفر حركات مرنة في الغلوبولين المناعي.
الهضم الأنزيمي للأجسام المضادة الهضم مع غلات البابين 3 أجزاء 2 فاب متطابق و 1 Fc Fab لأن الجزء الذي هو ملزم بالمستضد Fc لأنه وجد أنه يتبلور في التخزين البارد هضم البيبسين F (ab) 2 لا يوجد استرداد Fc ، هضم بالكامل تقليل Mercaptoethanol (يزيل روابط ثاني كبريتيد ) وأظهرت الألكلة.
IMMUNGLOBULI CLASS SWITCHING
مبدئيًا تحمل جميع الخلايا البائية المتطابقة مع مستضد IgM المخصص لذلك المستضد وتنتج IgM استجابة لهذا التعرض للمستضد فيما بعد ، تسمح إعادة الترتيب اللاحقة بتكوين أجسام مضادة من نفس خصوصية المستضد ولكن من غلوبولين مناعي مختلف الفئات في تبديل الصنف ، يمكن أن يرتبط نفس الجين VH بالتتابع بالتسلسل مع جينات CH مختلفة ، بحيث يكون الغلوبولين المناعي المنتج لاحقًا (IgG ، IgA ، IgE) له نفس خصوصية IgM الأصلي ولكن خصائص بيولوجية مختلفة. تم إطلاقه من الخلايا التائية وحدث أيضًا بعد تحفيز المستضد. · محددات مستضدات الجينات على الغلوبولين المناعي: 1-محددات النمط المتماثل: محددات المنطقة الثابتة في فئة السلاسل الثقيلة والفئة الفرعية ، وأنواع السلاسل الخفيفة داخل الأنواع. المنطقة الثابتة لـ Ab إذا قمت بحقن Ab في نوع مختلف ، يتم إنشاء النمط المضاد للنمط المتماثل إذا كان ضمن نفس النوع ، لا توجد محددات النمط المتماثل 2-Allotype: على الرغم من ظهور نفس الأنماط النظيرية مع نوع واحد الاختلافات الصغيرة (1-4 أ / أ) في أفراد مختلفين إذا تم حقنتهم بمثل هذا Ab ، فإنك تولد مضادًا للتخصيص Ab Ex. أثناء الحمل ، نقل الدم. 3-محددات النمط الوراثي: الفريد من نوعه VH و VL يربط المستضد ولكن يمكن أيضًا أن يتصرف كمحدد للمستضد إذا قمت بحقن جسم مضاد أحادي النسيلة في متلقي متطابق وراثيًا ، فسيتم إنشاء الأجسام المضادة المضادة للنمط المتماثل.
السمية الخلوية التي تعتمد على الجسم المضاد (ADCC) هي آلية للدفاع المناعي عن طريق الخلية حيث تقوم خلية مستجيبة في الجهاز المناعي بحل الخلية المستهدفة ، والتي ترتبط مستضدات سطح الغشاء بأجسام مضادة محددة. إنها إحدى الآليات التي يمكن من خلالها للأجسام المضادة ، كجزء من الاستجابة المناعية الخلطية ، أن تعمل على الحد من العدوى واحتوائها. الكلاسيكية ADCC SI بوساطة الخلايا القاتلة الطبيعية (NK) ؛ يمكن أن تتوسط الخلايا الضامة والعَدِلات والحمضات أيضًا ADCC. على سبيل المثال ، يمكن أن تكون الحمضات بمثابة الديدان الطفيلية من خلال ADCC. ADCC هو جزء من الاستجابة المناعية التكيفية بسبب اعتماده على استجابة مسبقة للأجسام المضادة. قتل بعض الديدان الطفيلية المعروفة.
الأجسام المضادة أحادية النسيلة
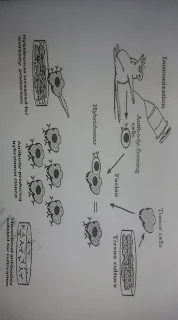
الأجسام المضادة أحادية النسيلة (m Abs) هي أجسام مضادة متطابقة لأنها تنتج عن نوع واحد من الخلايا المناعية ، وجميعها مستنسخات لخلية أم واحدة. الأجسام المضادة متعددة النسيلة هي أجسام مضادة مشتقة من خطوط خلايا مختلفة. • للأجسام المضادة استخدامات مهمة تتجاوز مكافحة الالتهابات في الجسم. • إنتاج الأجسام المضادة أحادية النسيلة طويلة الأمد هو اختراع حديث ويستخدم في كل من الطب والأبحاث. الجسم المضاد وحيدة النسيلة: جسم مضاد ثابت يمكن استخدامه على مدى فترة زمنية لإنتاج الأجسام المضادة وحيدة النسيلة 1. حقن فأر بمولد ضد معين لتحفيز جهازه المناعي لإنتاج الأجسام المضادة الضرورية. 2. استخراج خلايا طحال الفأر (تحتوي على الخلايا الليمفاوية ب) وزرعها في المختبر. RET 3. استخراج الخلايا السرطانية في الفئران ، والتي تنمو بشكل مستمر ، وزرعها في المختبر. 4. امزج خلايا الطحال والخلايا السرطانية على نفس الصفيحة والثقافة. 5. إضافة البولي إيثيلين جلايكول - يؤدي ذلك إلى اندماج بعض الخلايا الليمفاوية البائية مع الخلايا السرطانية لإنتاج خلية هجينة تسمى الورم الهجين. 6. تنمو الخلايا في ظل ظروف تسمح فقط لخلايا الورم الهجين بالبقاء على قيد الحياة. 7. استخراج الخلايا ، وزرعها بشكل منفصل واختبار الوسط حول كل خلية للجسم المضاد المحدد للفائدة. 8. زرع الخلايا لصنع الجسم المضاد المطلوب واستخدامه حسب الحاجة.
أنواع mAbs المصممة أ. mAbs مصدر Murine: mAbs للقوارض ذات الصلات والخصائص الممتازة ، التي تم إنشاؤها باستخدام تقنية الورم المائي التقليدي. ضعف الفعالية السريرية من خلال استجابة HAMA (الأجسام المضادة البشرية المضادة للفئران) ، مما يؤدي إلى فرط الحساسية المعقدة أو المناعية. ب. الكيمري mAbs: تجمع أجهزة chimers بين المناطق الثابتة للإنسان مع المناطق المتغيرة للقوارض السليمة. تقارب وخصوصية لم تتغير. يتسبب أيضًا في استجابة الجسم المضاد للكيمير البشري (30٪ من موارد الفئران) ج. mAbs المتوافقة مع البشر: تحتوي فقط على جزء صغير من المنطقة المتغيرة للقوارض المطعمة في إطار المنطقة المتغيرة البشرية. تطور الأجسام المضادة العلاجية.
علاج السرطان •
تحمل الخلايا السرطانية مستضدات محددة مرتبطة بالورم (TAA) على غشاء البلازما. تم إنتاج الأجسام المضادة أحادية النسيلة المضادة لـ TAA. الأدوية التي تقتل الخلايا السرطانية أو تثبط البروتينات الرئيسية في الخلايا السرطانية ترتبط بالأجسام المضادة أحادية النسيلة المضادة لـ TAA. يتم استهداف الخلايا السرطانية على وجه التحديد ، وتجنب تلف الخلايا المضيفة السليمة. ثلاث آليات يمكن أن تكون مسؤولة عن علاج السرطان. A. mAbs تعمل مباشرة عند الارتباط بمستضدات معينة للسرطان وتحفز الاستجابة المناعية للخلايا السرطانية. مثل تحفيز موت الخلايا المبرمج للخلايا السرطانية أو تثبيط النمو أو التدخل في وظيفة رئيسية. تم تعديل B.mAbs أو تسليم السيتوكين النظائر المشعة السامة أو غيرها من الاتحادات النشطة. من الممكن أيضًا تصميم أجسام مضادة ثنائية الخصوصية يمكنها الارتباط بمناطق Fab الخاصة بها لاستهداف المستضد والخلية المترافقة أو المؤثرة.
النظام التكميلي
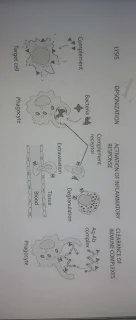
النظام التكميلي النظام المتمم هو جزء من جهاز المناعة يساعد أو يكمل مسببات الأمراض الواضحة من الكائن الحي. إنه جزء من جهاز المناعة الفطري. قدرة الأجسام المضادة وخلايا البلعمة يتكون النظام التكميلي من حوالي 25 بروتينًا تعمل معًا لمساعدة أو إكمال عمل الأجسام المضادة في تدمير البكتيريا ، وتدور البروتينات المكملة في الدم في شكل غير نشط. يتم تنشيطه - نموذجيًا عن طريق الأجسام المضادة التي تقفل على مستضد - وتحرك تأثير الدومينو. يأخذ كل مكون دوره في سلسلة دقيقة من الخطوات تعرف باسم السلسلة التكميلية. المنتجات النهائية عبارة عن أسطوانات جزيئية يتم إدخالها في فتحات وثقب في جدران الخلية للبكتيريا الغازية ، ويتدفق السائل والجزيئات داخل وخارج الخلايا البكتيرية بشكل جيد مما يؤدي إلى موت البكتيريا. المكونات التكميلية • تم تصنيعها بشكل رئيسي عن طريق خلايا الكبد الكبدية (حيدات الدم ، الخلايا الضامة للأنسجة ، الخلايا الظهارية في الجهاز الهضمي والجهاز الهضمي). • ينتشر معظمها في المصل في أشكال غير نشطة وظيفيًا مثل الإنزيمات الأولية (الزيموجينات). • شظايا الببتيد التي تشكلت عن طريق تنشيط أحد المكونات - الأجزاء الأكبر: ترتبط بالهدف بالقرب من موقع التنشيط - الأجزاء الأصغر: التهاب موضعي الأنشطة المتعددة للنظام التكميلي.
كيف يتم تفعيل النظام التكميلي؟
يمكن تفعيل النظام التكميلي بطريقتين رئيسيتين. الوسيلة الأولى للتنشيط هي جزء من الاستجابة المناعية الفطرية (الطبيعية). (1.e. لا تشارك الأجسام المضادة ولا مستقبلات الخلايا التائية.) على سبيل المثال ، يمكن لبعض السكريات الموجودة على سطح البكتيريا تنشيط النظام. يمكن أن يحدث هذا على الفور ولا يتطلب التعرض المسبق للجزيئات. تحدث الوسيلة الثانية والأكثر فاعلية في الاستجابة المناعية التكيفية عندما ترتبط الأجسام المضادة (IgG أو IgM) بمستضد على سطح الخلية A. هذا يفضح منطقة Fc من الجسم المضاد بطريقة تسمح للبروتين المكمل الأول (C1) بالارتباط. نظرة عامة على مسارات التنشيط التكميلية. 1-المسار الكلاسيكي UREE يشتمل هذا المسار على المكونات التكميلية C1 و C2 و C4. يتم تشغيل المسار بواسطة معقدات الأجسام المضادة - المستضد المرتبطة بـ C1 ، والتي تحتوي في حد ذاتها على ثلاثة مكونات فرعية Clq و Clr و Cls. يشكل المسار C3 convertase ، C4b2a ، والذي يقسم C3 إلى جزأين ؛ الجزء الكبير ، C3b ، الذي يعتبر أن الجزيئات المركزية يمكن أن تلتصق تساهميًا بسطح مسببات الأمراض الميكروبية وتطهيرها ؛ الجزء الصغير ، C3a ، ينشط الخلايا البدينة ، مما يتسبب في إطلاق الوسطاء النشطين في الأوعية مثل الهيستامين.
2-المسار البديل يتضمن هذا المسار عوامل مختلفة
، B ، D ، H & I ، والتي تتفاعل مع بعضها البعض ، ومع C3b ، لتكوين C3 convertase ، C3bBb ، الذي يمكنه تنشيط المزيد من C3 ، ومن ثم يُطلق على المسار أحيانًا اسم حلقة التضخيم ". يتم تعزيز تنشيط الحلقة في وجود مغلفات فيروسية لجدران الخلايا البكتيرية والفطرية ولكن يتم تثبيطها بواسطة الجزيئات الموجودة على سطح خلايا الثدييات الطبيعية.
3-مسار الليتين المرتبط بالمانوز
يتم تنشيط هذا المسار عن طريق ربط محاضرات ربط المانوز (MBL) ببقايا المانوز (بوليمر السكر) على سطح العامل الممرض. وهذا بدوره ينشط بروتينات السيرين المرتبطة بـ MBL ، و MASP-1 و MASP-2 ، والتي تنشط C4 و C2 ، لتشكيل C3 convertase ، C4b2a.
Lytic Pathway
يبدأ هذا المسار بتقسيم C5 وربط C5b بالهدف. تتحد C6 و C7 و C8 و C9 مع C5b ، ويمكن لمركب هجوم الغشاء (MAC) ، عند إدخاله في الغشاء الخارجي لبعض البكتيريا ، أن يساهم في موتها عن طريق التحلل. يمكن للخلايا الحمراء التي تحتوي على جسم مضاد مرتبط بسطح الخلية أيضًا تنشيط المسارات الكلاسيكية والليتية ، وتصبح عرضة للتحلل.